酚醛樹脂是重要的工業原料,尤其近幾年防火材料的大量使用,造成市場對酚醛樹脂需求量的逐年增加,生產企業也勢必會產生更多有毒有害的苯酚廢水。工業酚醛樹脂廢水中通常含有數千毫克/升、甚至更高濃度的苯酚,若不經處理直接排放不僅造成了苯酚資源的嚴重浪費,而且會對自然環境帶來嚴重污染和不可估量的損失。苯酚廢水的處理方法有很多,如生物化學法、吸附法、化學氧化法、萃取法、膜分離法等。對于高濃度的工業苯酚廢水,萃取法不僅能有效地降低廢水中苯酚含量,而且能實現苯酚的回收和循環使用。由于萃取法的操作簡便、設備要求低,連續操作和間歇操作均可以實現。近年,在苯酚萃取技術方面有很多關于碳酸二甲酯]、磷酸三異戊酯l1 、磷酸三丁酯(TBP)、4一甲基一2一戊酮L13]和辛醇L1 等有機溶劑對苯酚的選擇性能的報道。TBP因其性質穩定、對苯酚有高選擇性、價格低廉,是苯酚萃取劑的研究熱點。
本研究以TBP為萃取劑,以工業酚醛樹脂廢水為處理對象,研究了油水比、溫度、萃取級數、萃取時問等多個因素對萃取效果的影響。同時,通過正交實驗探討了NaOH溶液對有機相的反萃取效果,研究了萃取劑的循環使用性能及苯酚回收率。
1材料與方法
1.1主要試劑及儀器
某企業工業酚醛樹脂廢水(以下簡稱廢水):經過靜置沉降,苯酚質量濃度為2145.0mg/L,pH≈1;NaOH(工業級);TBP、苯酚、鐵氰化鉀、4一氨基安替比林、氨水、氯化銨(均為分析級)。
傅立葉紅外光譜儀;722N型可見分光光度計;SZCL一2型控溫磁力攪拌器。
1.2苯酚分析方法
水相中苯酚分析根據《水質揮發酚的測定4一氨基安替比林分光光度法》(HJ503--2009)測定。通過物料衡算可以得到有機相中苯酚濃度。
1.3實驗方法
1.3.1萃取
取6OmL廢水,置于250mL錐形瓶中,按油水比為1:3(體積比)加入2OmLTBP,在控溫磁力攪拌器上快速攪拌20min,于250mL分液漏斗中靜置分層,并重復上述操作進行4級萃取。取一定量水相,測定其苯酚濃度,通過物料衡算可以得到有機相中苯酚濃度。
1.3.2反萃取
有機相與設定濃度的NaOH溶液按一定油堿比混合于250mL錐形瓶中,在控溫磁力攪拌器上快速攪拌1h,于250mL分液漏斗中靜置分層,萃取劑循環使用,回收苯酚。
2結果與討論
2.1萃取單因素實驗
2.1.1TBP對不同苯酚初始濃度廢水的分配系數(D)因工業酚醛樹脂廢水的苯酚濃度在較大的范圍內會有變化,所以萃取劑對不同濃度的苯酚廢水要有較穩定的分配系數。取5組100mL廢水,1組稀釋4倍,2組稀釋2倍,3組不做處理,4組加入100mg苯酚,5組加入200mg苯酚,配制了如表1所示的5種不同苯酚初始濃度的廢水,用TBP進行一級萃取(油水比1:3)。
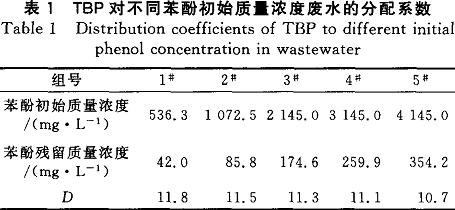
廢水稀釋了2、4倍,稀釋后的pH由1左右分別變為1.3、1.6,仍然具有較強的酸性。在酸性條件下,苯酚保持分子特性,即可以與TBP進行絡合反應。pH在酸性范圍內的變化,對TBP萃取苯酚的效果影響較弱,基本可以忽略。從表1可以看出,TBP對苯酚在一個較大的濃度范圍內都有較高且穩定的分配系數。這是由于TBP分子中的配價P—O的存在,使氧原子帶有更強的負電性,同時苯酚一0H中氧原子和氫原子的共用電子對強烈偏向于氧原子,使氫原子帶有較強的正電性。當2種分子接近時,TBP的P—O與苯酚的C—O會發生氫鍵締合。
圖1是苯酚與TBP絡合后的紅外吸收光譜圖。
在3600cm以上基本無紅外吸收,說明已沒有游離的酚羥基存在;在3340cm處出現了寬且強的吸收峰,可能是苯酚的一OH發生氫鍵締合的原因造成的;I240cm為TBP的P—O特征吸收峰,1038cm為苯酚的C一0特征吸收峰,較未締合前的1185、1269cm均發生了較大的紅移,也說明了TBP的P—O與苯酚C—O形成了較穩定的氫鍵締合。

2.1.2溫度對分配系數的影響
苯酚和TBP由于存在氫鍵締合,在水和TBP中存在以下平衡:

式中:n為化學反應系數;K為平衡常數;z、32、32。分別為有機相中苯酚和TBP的絡合物、有機相TBP、水相苯酚的摩爾濃度,mol/L。當達到萃取平衡時其分配系數為:
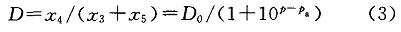
式中:.z、z分別為有機相苯酚、水相中游離苯酚的摩爾濃度,mol/L;D。為理論分配系數;P為pH;P為酸堿解離常數(pK)。因為pK=9.87,所以酸性條件下可認為D=D。。則式(2)和式(3)式可以轉換為:
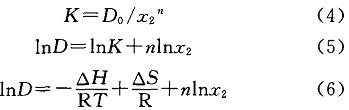
式中:△H為焓變,J/tool;R為理想氣體常數,J/(mol?K),R一8314J/(tool?K);T為溫度,K;AS為熵變,J/mol。一般認為,熵變不隨溫度變化,則式(6)可簡化為:
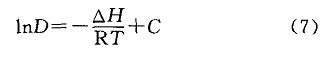
式中:C為簡化相。
圖2是TBP對苯酚的分配系數與溫度的關系。經線性擬合,可以求得TBP對苯酚的焓變為一1O.1kJ/mol,與文獻E19]報道的數值相近。一般,氫鍵的能量為4.2~42.0kJ/mol,因此也可認為TBP與苯酚之間形成了氫鍵締合物。由焓變可以確定,TBP與苯酚的絡合過程是一個放熱的過程,高溫不利于萃取進行,因此在室溫下進行苯酚萃取是合理的。
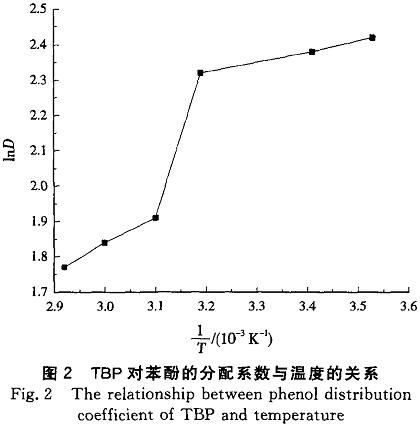
由于溫度313K以上,苯酚在水中的溶解度呈現指數型上升,同時溫度較高時,TBP在水中的溶解度也增大,使TBP對苯酚的分配系數迅速下降,因此lnD出現了一個較大范圍的跳躍(見圖2)。
2.1.3油水比和萃取級數對萃取效果的影響
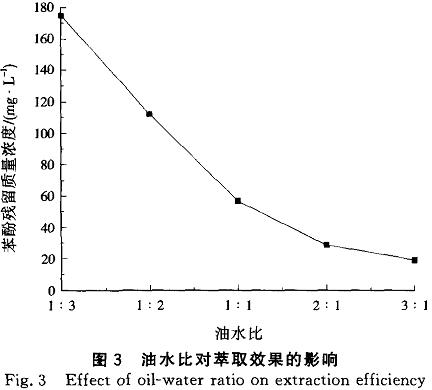
由圖3表明,隨著油水比的增大,苯酚殘留濃度減少,即苯酚在TBP中的分配系數增大,這是由于苯酚分子周圍有更多的TBP分子,增加了氫鍵締合的機率。但是增大油水比雖有較好的萃取效果,卻大幅度降低了單次廢水的處理量,對于工業廢水的處理除考慮效果外還要兼顧效率,因此油水比選擇更適合工業實際的1:3。
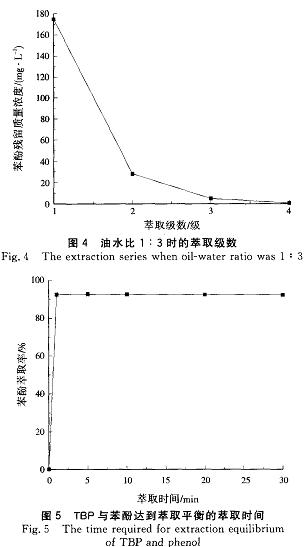
式(8)可近似計算廢水達到《污水綜合排放標準》(GB8978--1996)中揮發酚一級排放標準(0.5mg/L)所需的理論萃取級數(N)。根據表1,油水比為1:3時,取TBP對苯酚的分配系數為11.0進行計算,廢水達標所需的理論萃取級數為4級。由圖4可見,當油水比為1:3時,達標所需的實際萃取級數與理論萃取級數相同,均為4級。

2.1.4萃取時間對萃取效果的影響
萃取時間是萃取劑性能的一個重要指標。在實際廢水處理中,較短萃取時間不僅可以提高廢水處理效率,而且降低了廢水處理成本。圖5為TBP與苯酚達到萃取平衡的萃取時間。由圖5可見,1rain左右,TBP與苯酚廢水即可達到萃取平衡,可見TBP對苯酚具有很好的選擇性能。考慮到實驗室廢水處理量較小,攪拌1min基本可以混勻,但實際工業操作時廢水量巨大,充分攪拌需要較長時間,為保持實驗結果的穩定性,故萃取時間選為2Omin。
2.1.5最佳萃取條件
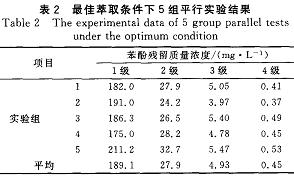
通過單因素實驗,確定了TBP對苯酚的最佳萃取條件:室溫,油水比1:3,萃取時問20min,4級萃取。在最佳萃取條件下進行5組平行實驗,結果見表2。每組實驗結果都較穩定,4級萃取后苯酚殘留質量濃度平均值為0.45mg/L,達到GB8978~1996中揮發酚一級排放標準。
從表4可以看出,NaOH濃度對苯酚回收率的影響最小。在反萃取過程中,NaOH起到解絡合的作用,在反萃取體系中要有足夠的自由堿濃度,才能保證反萃取的進行。

因企業廢水中苯酚濃度會發生變動,故采用0.50tool/L的NaOH溶液做反萃取劑。當油堿比為1:1、1:2時,均具有較好的苯酚回收率。考慮到減少NaOH溶液用量可以降低苯酚回收成本,提高經濟效益,因此選擇油堿比為1:1。由于TBP經過2級反萃取后,其中的苯酚含量很低,TBP不經過第3級反萃取進人循環,不影響其萃取性能,且TBP中殘余的微量苯酚經過萃取劑的循環后也可回收,因此選擇2級反萃取。綜合確定最佳反萃取條件:0.50mol/LNaOH溶液,油堿比1:1,反萃取級數2級。在此最佳反萃取條件下,可回收9O9/6左右的固體苯酚。

由圖6還可見,多次循環后,TBP萃取苯酚的效率有小幅度的提高,可能是由于進行反萃取時有部分NaOH溶解到TBP中,當TBP再循環萃取廢水時,TBP中的NaoH與酸性廢水部分酸堿中和形成了鹽。由于鹽具有水合作用,吸引了部分自由水分子,使廢水中的自由水分子的含量減少,廢水中苯酚濃度相應增加,從而有利于TBP萃取苯酚。
3結論
(1)TBP對苯酚在一個較大的濃度范圍內都有較高且穩定的分配系數。
(2)紅外吸收光譜圖顯示,TBP的P—O特征吸收峰和苯酚的c—O特征吸收峰較未締合前發生了較大的紅移,說明TBP的P—O與苯酚c—O形成了較穩定的氫鍵締合。
(3)經TBP對苯酚的分配系數與溫度關系的線性擬合,可以求得TBP對苯酚的焓變為一10.1kJ/mol,可以確定TBP與苯酚的絡合過程是一個放熱的過程。
(4)TBP對苯酚的最佳萃取條件:室溫,油水比1:3,萃取時間2Omin,4級萃取。在最佳萃取條件下,4級萃取后苯酚殘留質量濃度平均值為0.45mg/L,達到達到GB8978--1996中揮發酚一級排放標準。
(5)最佳反萃取條件:0.50mol/LNaOH溶液,油堿比1:1,反萃取級數2級。在此最佳反萃取條件下,可回收9O左右的固體苯酚。
免責聲明: 本文僅代表作者個人觀點,與 綠色節能環保網 無關。其原創性以及文中陳述文字和內容未經本站證實, 對本文以及其中全部或者部分內容、文字的真實性、完整性、及時性本站不作任何保證或承諾,請讀者僅 作參考,并請自行核實相關內容。